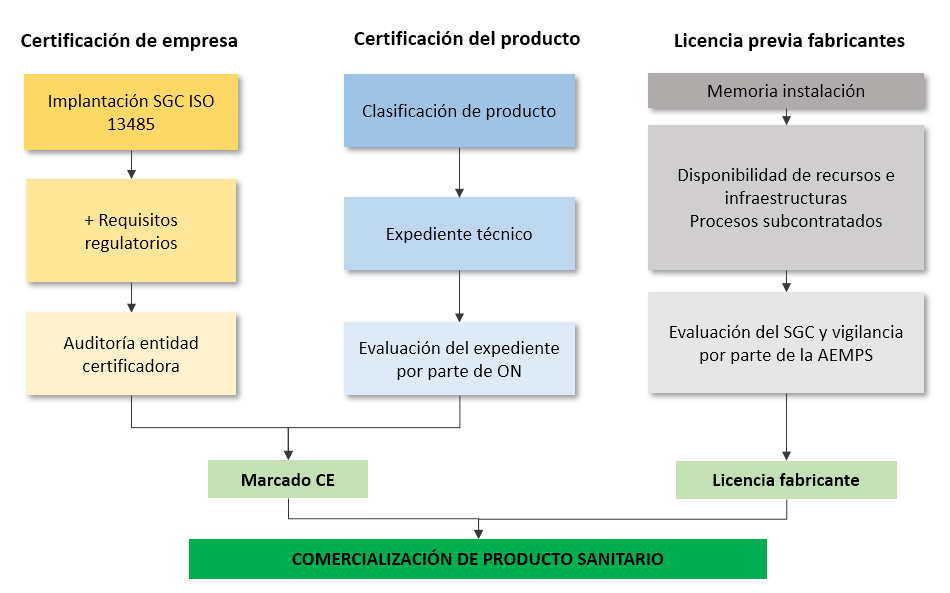
Clases de productos sanitarios
Un producto sanitario es un producto o pieza de equipo que una persona utiliza con fines médicos. No es un medicamento o una droga. Los productos sanitarios pueden diagnosticar, controlar o tratar enfermedades y ayudar a las personas con discapacidades físicas a ser más independientes.
No utilice el dispositivo si le preocupa su calidad, por ejemplo, si no se siente bien al utilizarlo como se describe en las instrucciones. Póngase en contacto con su profesional sanitario al respecto e informe al fabricante y al MHRA mediante la Tarjeta Amarilla.
Los medidores de glucosa en sangre son utilizados habitualmente por las personas con diabetes para controlar los niveles de glucosa en sangre. Normalmente los recomienda un profesional sanitario, como un médico de cabecera o un especialista en diabetes.
Su profesional sanitario le ayudará a elegir el mejor medidor para usted. Asegúrese de seguir las instrucciones del fabricante de su medidor en particular, que se encuentran en el folleto que se entrega con el medidor. Un miembro de su equipo de atención a la diabetes debe formarle correctamente antes de que empiece a utilizar el medidor.
Definición de producto sanitario de la Fda
Algunos medicamentos se utilizan en combinación con un producto sanitario, normalmente para permitir la administración del medicamento.Si la acción principal prevista se consigue con el medicamento, se considera un medicamento que incluye un producto sanitario.El producto completo está regulado por la legislación farmacéutica de la UE (Directiva 2001/83/CE o Reglamento (CE) nº 726/2004) y debe obtener una autorización de comercialización de un medicamento.La parte del dispositivo de la combinación puede requerir una evaluación de conformidad, como se indica a continuación: Tipo de combinaciónIlustraciónEvaluación de la conformidad del productoIntegralEnvasado conjunto u obtenido por separadoFunción de EMAEMA es responsable de evaluar la calidad, la seguridad y la eficacia de las solicitudes de autorización de comercialización evaluadas mediante el procedimiento centralizado, incluida la seguridad y el rendimiento de un producto sanitario en relación con su uso con un medicamento. El producto sanitario puede estar empaquetado con el medicamento, obtenerse por separado o ser parte integrante del mismo. En julio de 2021, la EMA publicó una directriz final sobre la documentación de calidad de los medicamentos que incluyen un producto sanitario. En ella se aclaran las expectativas establecidas en la Directiva 2001/83/CE y se abordan las obligaciones del Reglamento de Productos Sanitarios, en particular el artículo 117. La EMA recomienda leer la directriz junto con las preguntas y respuestas sobre la aplicación del Reglamento sobre productos sanitarios y el Reglamento sobre productos de diagnóstico in vitro.
Productos sanitarios de clase 1
El término Dispositivos Médicos, tal como se define en la Ley de Alimentos y Medicamentos, abarca una amplia gama de instrumentos sanitarios o médicos utilizados en el tratamiento, la mitigación, el diagnóstico o la prevención de una enfermedad o condición física anormal.
Este plan establece una estrategia en tres partes para seguir mejorando la forma en que los productos sanitarios llegan al mercado, reforzar la supervisión y el seguimiento de los productos que ya están en uso y proporcionar a los canadienses más información sobre los productos sanitarios de los que dependen.
Los dispositivos médicos también pueden requerir la certificación de la Comisión Canadiense de Seguridad Nuclear (CNSC) antes de obtener la licencia para actividades operativas o de mantenimiento. Visite el sitio web de la CNSC y lea los requisitos de certificación para obtener más información.
También proporcionamos información para apoyar el papel de la autoridad reguladora federal, como el Grupo de Trabajo de Armonización Global de Dispositivos Médicos, los Comités de Asesoramiento Científico, las Reuniones de la Asociación y los Informes de Rendimiento. Muchas de estas actividades se llevan a cabo con la participación de clientes, partes interesadas y el público en general.
Reglamento de productos sanitarios deutsch
El texto que se ofrece en este sitio web se basa en las Directivas vigentes. La legislación europea sobre productos sanitarios ha sido revisada significativamente por dos nuevos Reglamentos europeos que entrarán en vigor en los próximos años. Puede encontrar más detalles sobre estos nuevos Reglamentos en nuestra página de Nuevos Reglamentos sobre productos sanitarios Acerca de los productos sanitarios
El término “producto sanitario” abarca todos los productos utilizados en el ámbito de la asistencia sanitaria para el diagnóstico, la prevención, el seguimiento o el tratamiento de una enfermedad o discapacidad y que ejercen su acción principal por medios físicos.
Incluye: lentes de contacto y preservativos; válvulas cardíacas y camas de hospital; resucitadores y máquinas de radioterapia; instrumentos quirúrgicos y jeringuillas; sillas de ruedas y andadores u otros productos de tecnología asistencial; pruebas de embarazo, monitores de glucosa en sangre y marcapasos.
El ámbito de aplicación de la normativa sobre productos sanitarios incluye también los productos sanitarios de diagnóstico in vitro (DIV). Un producto sanitario de diagnóstico in vitro incluye cualquier producto sanitario (como un reactivo, un producto reactivo, un calibrador, un material de control, un instrumento o un aparato) que se utiliza solo o en combinación y que está destinado por el fabricante a ser utilizado in vitro para proporcionar información sobre, por ejemplo, un estado fisiológico o patológico o para controlar las medidas terapéuticas. Entre ellos se encuentran los kits de pruebas de embarazo, las tiras reactivas para análisis de orina y los recipientes para muestras (como los tubos de recogida de sangre).
